专栏文章
初中化学
学习·文化课参与者 24已保存评论 33
文章操作
快速查看文章及其快照的属性,并进行相关操作。
- 当前评论
- 33 条
- 当前快照
- 1 份
- 快照标识符
- @miotijuh
- 此快照首次捕获于
- 2025/12/03 00:54 3 个月前
- 此快照最后确认于
- 2025/12/03 00:54 3 个月前
初中常用元素
注:相对原子质量题里面会给。
相对原子质量: 质量的 ,差不多是半个质子加半个中子,再差不多就可以算作是一个质子或者一个中子。(电子质量过小忽略不计了)
| 核电荷数 | 元素名称 | 元素符号 | 常用化合价1 |
|---|---|---|---|
| 1 | 氢 | H | +1 |
| 2 | 氦(hai4) | He | 0 |
| 3 | 锂 | Li | US |
| 4 | 铍(pi2) | Be | US |
| 5 | 硼(peng2) | B | US |
| 6 | 碳 | C | +2,+4 |
| 7 | 氮 | N | -3,+2,+4,+5 |
| 8 | 氧 | O | -22 |
| 9 | 氟(fu2) | F | US |
| 10 | 氖(nai3) | Ne | 0 |
| 11 | 钠 | Na | +1 |
| 12 | 镁 | Mg | +2 |
| 13 | 铝 | Al | +3 |
| 14 | 硅 | Si | US |
| 15 | 磷 | P | -3,+3,+5 |
| 16 | 硫 | S | -2,+4,+6 |
| 17 | 氯(lv4) | Cl | -1,+1,+5,+7 |
| 18 | 氩(ya4) | Ar | 0 |
| 19 | 钾 | K | +1 |
| 20 | 钙 | Ca | +2 |
| 25 | 锰(meng4) | Mn | +2,+4,+6,+7 |
| 26 | 铁 | Fe | +2,+3 |
| 29 | 铜 | Cu | +1,+2 |
| 30 | 锌(xin1) | Zn | +2 |
| 47 | 银 | Ag | +1 |
| 56 | 钡(bei4) | Ba | +2 |
稀有气体
写一点吧。
分别是氦,氖,氩,氪,氙(xian1),氡(dong1)。(注意没有氮,我小学一直以为氮是。不过氮化学性质也很稳定,含量也很高,在空气中的体积分数大概是 。剩下的空气中 氧气,还有二氧化碳等)
其实就是元素周期表最后一列, 号元素 (这个字太抽象了,输入法里没有)除外。
这里顺便讲一下元素周期表:同一行的电子层数相同(最底下那两行归到镧(lan2)系和锕(a1)系那里,不算单独一行),同一列最外层电子数相同( 除外,因为它是高贵的第一层,受 的限制而不是 的限制)。
原本叫做“惰性气体”(意为不与其他物质反应的气体),但是其实也能反应,所以改名了。
叫“稀有”是因为含量极少。
稀有气体均无色无味难溶于水,化学性质稳定,可以做“保护气”。
这些气体通电时会发光(很漂亮,大家可以去看看图,保养自己被奶龙图污染的眼睛),因为通电时没有产生新的物质所以这是物理变化。
其中,氦 密度最小,仅为空气的 左右,所以有氦气球。
金属活动性顺序表
从左往右越来越不活泼↓
过于活泼,初中不深入研究。
在 后 前的金属比较活泼,可以与稀盐酸或者稀硫酸发生置换反应产生盐和氢气。
后面的金属比较不活泼,不能与稀盐酸或者稀硫酸反应。
在表中排行靠前的金属可以把排行靠后的金属从它的盐溶液中置换出来。如 。
画原子结构示意图
先画一个圆,然后里面标 ,其中 为其核电荷数(电子数、质子数)。
由于一般只会画 的,所以可以直接按照规律依次填满内层电子,然后再外层。
每层最多 个。特别的,最外层最多 个。
特别注意 , 是 , 是 。
基本反应类型
- 化合反应
由多种反应物发生化学反应,只生成一种生成物的反应
- 分解反应
由一种反应物生成多种生成物
- 置换反应
由一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应
- 复分解反应
由两种化合物互相交换成分,生成另外两种化合物的反应,“双交换价不变”。发生条件:必须能产生水、沉淀或气体。
原子团(“——根”)3
| 氢氧根 | 碳酸根 | 硫酸根 | 硝酸根 | 铵根 | 高锰酸根 |
|---|---|---|---|---|---|
| -1 | -2 | -2 | -1 | +1 | -1 |
分子/离子读法
-
由两种元素组成的化合物:从右到左读“A 化 B”( “氯化钠”)5
-
、 的不同价:: 价“铜”, 价“亚铜”;: 价“铁”, 价“亚铁”。
一些物质的制取7
氧气
操作细节:
读作“过氧化氢”。
记得先检查气密性。下同。
如果用长颈漏斗,则一定要让溶液(该实验中即 )没过长颈漏斗末端。
可以用排水法/向上排空气法。
若为向上排空气法,检查氧气是否收满一瓶的方法是检验瓶口是否为氧气,即将带火星的小木条放在集气瓶口。下同。
操作细节:
试管口一定要低于试管底。加热的实验下同。
且在试管口要塞一团棉花。易升华的加热下同。
可以用排水法/向上排空气法。
组装要遵循从左到右,从下到上的顺序。
最后要先把集气瓶拿出来再关火。
电解水。
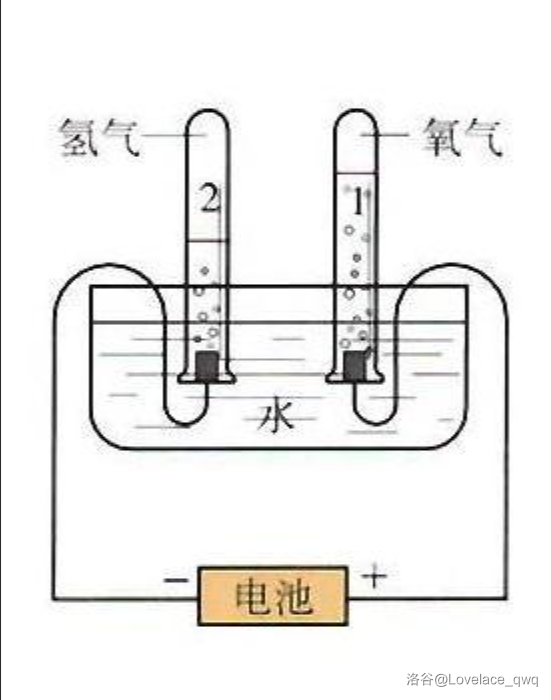
(感谢Lovelace_qwq(1223290)提供的图片)
要加一点氢氧化钠或者硫酸增强导电性。
负极产生氢气,正极产生氧气。
另外如果想在家里做,不要拿家庭电路。除非你喜欢以 频率震动的分子。
氢气
或者电解水,详见上文。
二氧化碳
还会剩下一点氧气和一氧化碳,但是非常不好配平,我不管了(摊手
算是一个吧。
由含碳化合物因氧气供应不足导致的不完全燃烧(热值相对于完全燃烧时仅有四分之一)形成,可以继续烧,而且会因为与血红蛋白导致一氧化碳中毒。一定不要关窗烧炉子!
一氧化碳无色无味难溶于水,密度比空气略小(所以收集时要用排水法),燃烧发出浅蓝色火焰。
操作细节:
不能用排水法,因为二氧化碳易溶于水。
因为盐酸()易挥发,所以可以放一些饱和 溶液吸收 。
有个“启普发生器”,稍微讲一下。
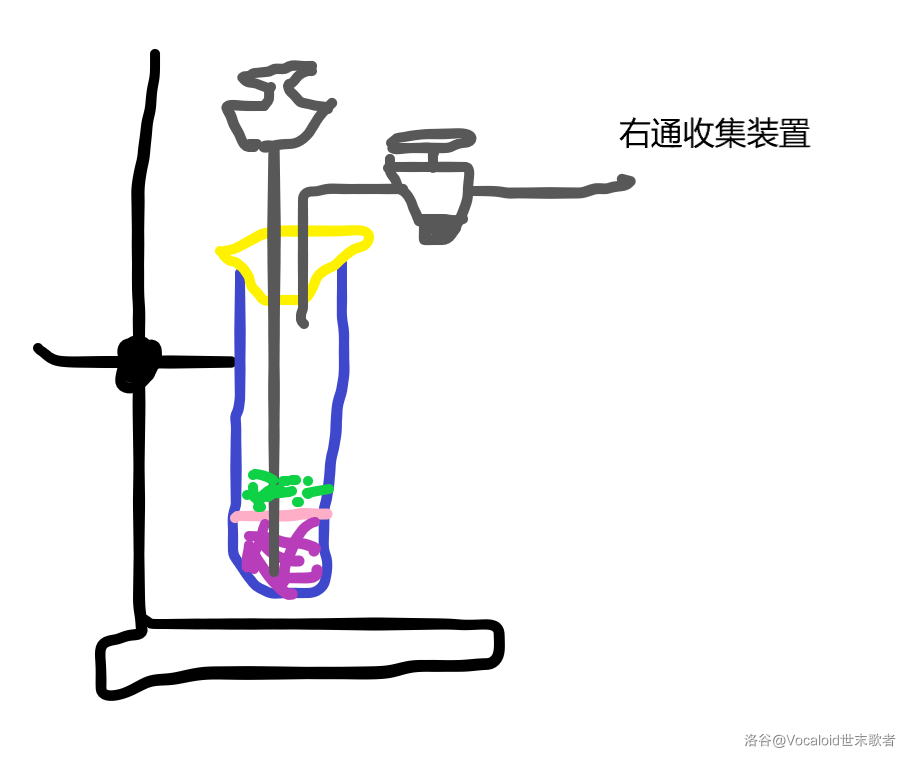
黑色的是铁架台,灰色的从左往右分别是长颈漏斗、玻璃管和活塞,黄色的是开有两个孔的试管塞,粉色的是一个多孔隔板,紫色的是液体(通过长颈漏斗加),绿色的是块状固体。
这玩意非常牛X,因为是由荷兰科学家启普发明的所以叫“启普发生器”,我们这里这个是丐版。
它可以实现“随开随用,随关随停”,也就是说,你打开活塞就能产生气体,关了它就不反应了,原理是关闭活塞后内部气体压强增大,将液体压回长颈漏斗。
启普发生器非常适合做不溶于水的块状固体和液体发生发应的实验。可惜不能加热,也不能用于溶于液体的固体或者粉末状固体(会从孔里面漏下去)与液体的反应。不过还是很牛X就对了。
酸,碱,盐,以及第九章
酸
电离8时生成的阳离子全部是氢离子的化合物叫做酸。剩下的阴离子就叫“酸根离子”。
盐酸和硝酸都易挥发,硫酸不易挥发。
氯化氢极易溶于水,硫酸和硝酸可以以任意比例与水互溶。
硫酸密度比水大。
硝酸见光、受热分解,所以保存在棕色的瓶子里。
酸可以与一些金属氧化物发生复分解反应并产生盐和水,比如 。
酸可以与金属活动性顺序表中排在氢之前的金属发生置换反应,产生盐和氢气。比如 。
酸可以与一些盐反应,产生另一种酸和另一种盐。
碱
电离时所生成的阴离子全部是氢氧根离子的化合物称为碱。
熟石灰/消石灰 ,其水溶液叫石灰水(就是能检测 那个)。
石灰石(主要是 )高温煅烧可以分解为 和 (生石灰)。生石灰再加水产生熟石灰,同时放出大量的热。
火碱/烧碱/苛性钠 ,腐蚀性强。
会吸收空气中的水分,此现象被称为潮解。发生的是物理变化。
称量 的时候要用玻璃片或者小烧杯,不能用称量纸。
碱可以与一些非金属氧化物发生反应并产生盐和水,比如 。注意这不是复分解反应,但还是化合价不变。
碱可以与一些盐反应,产生另一种碱和另一种盐。
中和
酸可以和碱发生复分解反应,产生盐和水。溶液的 值也会向 靠近。
盐
由金属或铵根离子和酸根离子组成的化合物统称为盐。
可溶盐的性质是它电离出的几种离子的性质总和。
可以根据盐的阴/阳离子将盐分类。
氯化钠,易溶于水,水溶液呈中性。
氯化钠是食盐的主要成分,可以以 的质量分数配置生理盐水。
碳酸钙,极难溶于水,是石灰石和大理石以及珍珠的主要成分。
碳酸钠,俗称纯碱(其溶液显碱性)、苏打(注意没有“小”),易溶于水。
碳酸钠加水可以看到它结块,过一会又会失水风化变回白色粉末,就很好玩。西西弗碳酸钠
(,)碳酸氢钠,俗称小苏打,可溶于水,其水溶液呈弱碱性。
碳酸氢钠可以与盐酸反应生成水和二氧化碳,。
它可以加进面团,中和酵母菌产生的酸。
常见物质溶解性表10
| 2 | 2 | 2 | 就是 | 2 | |
| 2 | 2 | 2 | 2 | 2 | |
| 2 | 2 | 2 | 2 | 2 | |
| 2 | 2 | 2 | 2 | 2 | |
| 2 | 2 | 1 | 1 | 0 | |
| 2 | 2 | 0 | 2 | 0 | |
| 2 | 2 | 2 | 0 | 1 | |
| 2 | 2 | 2 | 0 | X | |
| 2 | 2 | 2 | 0 | 0 | |
| 2 | 2 | 2 | 0 | 0 | |
| 2 | 2 | 2 | 0 | 0 | |
| 2 | 2 | 2 | 0 | X | |
| 2 | 2 | 2 | 0 | X | |
| 2 | 0 | 1 | X | 0 |
初中七大沉淀(有兴趣可以取表里找):
三碱
四盐
有机物
初中学的不多,速通一下。
甲烷 ,是天然气和沼气的主要成分,还存在于可燃冰中。无色无味,密度小于空气,难溶于水。
为什么不叫“四氢化碳?”有机物有特别的读法。
甲烷的“甲”代表里面有一个 原子,用十天干来代表有机物中 原子的数量。
“烷”的话,我弃了,这个在初中真没用(
乙醇 ,俗称酒精(貌似学名有一个也是酒精)。
为什么不写作 ?又是有机物的美妙东西了,这里的 叫羟(qiang3)基(注意这玩意不带电,不是氢氧根),初中阶段你别管是啥,反正有用就对了。
乙醇无色,有特殊香气,可以与水以任意比例互溶,还可以燃烧并放出大量的热(你猜酒精灯烧的是啥)。
有时候可能会考工业酒精,里面含有甲醇 ,同样有香味,但是有毒,会使人失明甚至死亡。所以我们一定不能在酒精灯里添加工业酒精。
还可能考发酵,其实就是酵母菌等分解葡萄糖()产生二氧化碳(面团里孔的来源)和酒精(面团里挥发了,所以吃馒头不算饮酒)。化学式 。怎么感觉会考做馒头,同时考有机物和碱
然后是乙酸 ,俗称醋酸,是食醋的主要成分。这玩意也是一种酸,所以也具有酸的特性。
这里的 叫羧(suo1)基。怎么有机物全是这种达芬名字和达芬读音啊
纯净的乙酸无色,有刺激性气味,具有腐蚀性。直接喝这玩意跟喝上面提到的甲醇差不多,所以乙酸在食醋中仅占比 。
它的熔点比较低,大约是 。凝固的醋酸因为很像冰(根本不像,)也被称为“冰醋酸”。
化学合成材料,化学能的利用,化学物质与健康
这个直接当大运创过去就行。基本上不是生活常识就是在其他科目(比如早夭的生物课)上学过。
一些乱七八糟的不知道归到哪的玩意
检查气密性
用手捂住反应容器(如果是加热的实验直接拿酒精灯外焰对着加热就行),观察在水中有无气泡冒出,然后松手,如果水被吸上去了就说明气密性良好。
氢气验纯
氢气的密度只有空气的 11(所以可以拿来做气球),无色无味难溶于水,可燃。
点燃不纯净的氢气时会爆炸,很危险,所以想拿二战巨型飞艇炸学校的同学们一定记得跑远点再点火,而且要混点氧气进去。
收集一小管氢气,用拇指堵住试管口(别把手烧了),使试管口稍微向下倾斜并接近酒精灯,移开拇指点火,将世界调成静音, 聆听氢气发出的声音。纯净的氢气是“噗”(差不多意思,反正人类的拟声词就是一坨)一声,不纯净的氢气是尖锐的爆鸣声(我不知道爆鸣声是啥样,反正很刺耳)。
点燃氢气,纯净的氢气是淡蓝色的火焰,化学式为 。
氢气相关的,还有一个“热值”:单位质量的染料完全燃烧后所放出的能量。
氢气热值非常高,是汽油的三倍多,所以应用前景广。当然不太好制备,你总不能拿一堆水,耗一堆电来电解吧。 说是目前有潜力的是一种(我觉得过于抽象的方法)方法:。
碳老祖
首先,我们先过来给碳老祖点一柱高香(当然,这炷香也是含有碳的),给碳老祖磕个头。感谢碳的优异化学性质让生命(至少是碳基的)得以存在。
然后我们再点一炷香,因为是因为碳优异的化学性质让人类有了大量的燃料(当然不是无尽的,所以要节约能源)。
接着我们再点一炷香,因为碳已经深深渗透进人类社会,你脸上为了抵御敌人毒气攻击戴的防毒面具,你妈或者什么亲戚喜爱的钻石首饰都含有碳。甚至你考试用 2B 铅笔也是碳的功劳。
最后我们再点一炷香,因为碳现在有着非常逆天的应用未来,以后我们不管是冲播种达到伟大还是搞黑洞灌注结束人类点满挑战基因的历程都会用到它。
好,现在你的桌子上(这也含有碳)沾满了渣了。快说:谢谢碳老祖。
碳因为结构特殊有着多种不同的单质。这不是像磷那样有 啊 啊这样的不同,是真正的结构不同(待会会举例)。
具有规整的微观结构的单质碳叫“定形碳”,不具有的叫“无定形碳”。常见的定形碳有组成你身上钻石甲的金刚石,和你铅笔上的石墨。
金刚石无色透明(你的钻石甲因为有杂质所以是蓝的),是自然界中存在的最硬的物质。注意:最硬不等于你拿铁锤敲不碎。比较硬度的方法是让两个物质互相划拉。很难想象第一个发现这玩意的科学家经历了什么
石墨是灰黑色的,柔软而且有点滑(摸摸铅笔就知道了)。能导电导热,耐高温。铅笔主要是石墨粉和黏土混合而成,上面写的“?H”“?B”就是说他这两种物质所含的多少。H 的硬度大,黏土多;B 的更黑,石墨多。
金刚石和石墨中碳的连接方式不同,可以取搜搜图就知道了。不过石墨在一定条件下可以转化为金刚石,注意这是个化学变化,虽然都是碳单质但石墨和金刚石是两种物质。
还有一种特殊的定形碳是有碳原子形成一个分子,然后由分子构成物质,最出名的一个是 ,俗称“足球烯”或者“富勒烯”。顾名思义,这玩意长得和足球一模一样。发明足球的人真是个天才
无定形碳则没有固定的结构,木炭(燃料,可以冶炼)、活性炭(疏松多孔所以有吸附性,可以做防毒面具)、炭黑(做碳素墨水)。
常温常压下碳的化学性质很稳定。
碳可以还原氧化物(矿石主要就是氧化物),比如 。
这是个经典的置换反应。其中, 叫还原剂, 叫氧化剂, 是还原产物, 是氧化产物。
上文提到的一氧化碳也可以用于冶炼。
例如,。
制备一氧化碳,靠不完全燃烧不太现实,一般是用 。
化学大题的过程
注意,此标准可能仅适用于 GD 的同学。

这是我在练习册上写的,所以是蓝笔,考试的时候要用黑笔。
注意一下格式,写“解:”,第一行设未知数,第二行写化学式,第三行写已知的和要求的化合物/单质的个数 它的相对分子质量,第四行写已知的和要求的化合物/单质质量,第五行根据第三、四行写的列方程,第六行写方程的解,第七行答。
溶液
溶解相关的知识点
被溶解的物质叫溶质,溶解溶质的叫溶剂,加起来叫溶液。
有时候考试会考:溶液的质量变化,注意溶液质量不包括放在溶液里但是没溶解的东西(比如你扔一块铁到盐水里)。
溶液一般是稳定的(外界条件不变时溶质不会与溶剂分离),均一的(不会一边浓度大一边浓度小),透明的(不一定无色,比如蓝的硫酸铜12)。
一般来说液体是溶剂,两种液体互溶认为量多的是溶剂,其它液体和水互溶认为水是溶剂。
还有一个“悬浊液”和“乳浊液”,记住悬浊液是不溶的固体颗粒形成的(比如水里面加沙子),乳浊液是不溶的小液滴形成的(比如水上面滴油)。乳浊液可以加洗洁精乳化,变得相对稳定。
有些物质溶解时没有明显热效应(氯化钠),有的放热温度升高(浓硫酸),有的吸热温度降低(氯化铵)。
饱和溶液
一定温度下,一定量的溶剂,如果不能再溶解某物质,就是这种物质的饱和溶液,如果还能溶解就是不饱和溶液。
一般来说,降温、加溶质、减溶剂可以让不饱和溶液变成饱和溶液,反之则可以把饱和的变成不饱和的。
然后记三个物质:硝酸钾(溶解度随温度升高而明显升高),氯化钠(溶解度随温度变化较小,缓慢增高),硫酸钾(溶解度随温度升高而变小)。
定义某溶质在 克溶剂中的溶解度为达到饱和状态时溶解的质量。
| >10g | 1~10g | 0.01~1g | <0.01g |
|---|---|---|---|
| 易溶 | 可溶 | 微溶 | 难溶(有时称为不溶) |
注意一下术语↑
液体和气体的溶质
液体中有一些特殊的(比如酒精)可以与水以任意比例互溶,对于它们不能讨论溶解度。
气体溶质一般用体积来算溶解度(在一个标准大气压下)。例如氮气在 时在水中的溶解度是 ,就是说氮气在 、压强为 时, 体积的水中最多可以溶解 体积的氮气。
气体溶解度一般随温度升高而减小,随压强增大而增大。
溶质的质量分数
没啥好说的,就是 。
做题的时候注意溶质也算是溶液的一部分,如果可以直接算就直接算,否则列方程(小学就练过了)。
结晶
晶体是由大量微观粒子按一定规则有序排列得到的有一定几何形态的固体。典型的例子是氯化钠,还有冰糖。
由溶质形成晶体的过程叫做结晶,一般结晶有冷却结晶和蒸发结晶两种。
金属相关的
氧化
和酸的反应
部分金属可以和稀盐酸或者稀硫酸发生置换反应,产生盐和氢气。
例如,,生成硫酸亚铁,是绿色的。
与其他金属的盐溶液发生的反应
上面在讲金属活动性顺序表的时候提了一句。
举个例子(我觉得最漂亮的一个反应),观察到有银白色物体(其实就是银,但是你不是丁真你不能在“实验现象”中写“有银析出”),溶液变成蓝色(也就是反应出硝酸铜)。
另外注意反应前如果盐溶液中有铁,那么生成的还是亚铁的盐。
冶炼金属
这个可能会考。
有一个“模拟工业炼铁”的实验,大概讲一下。
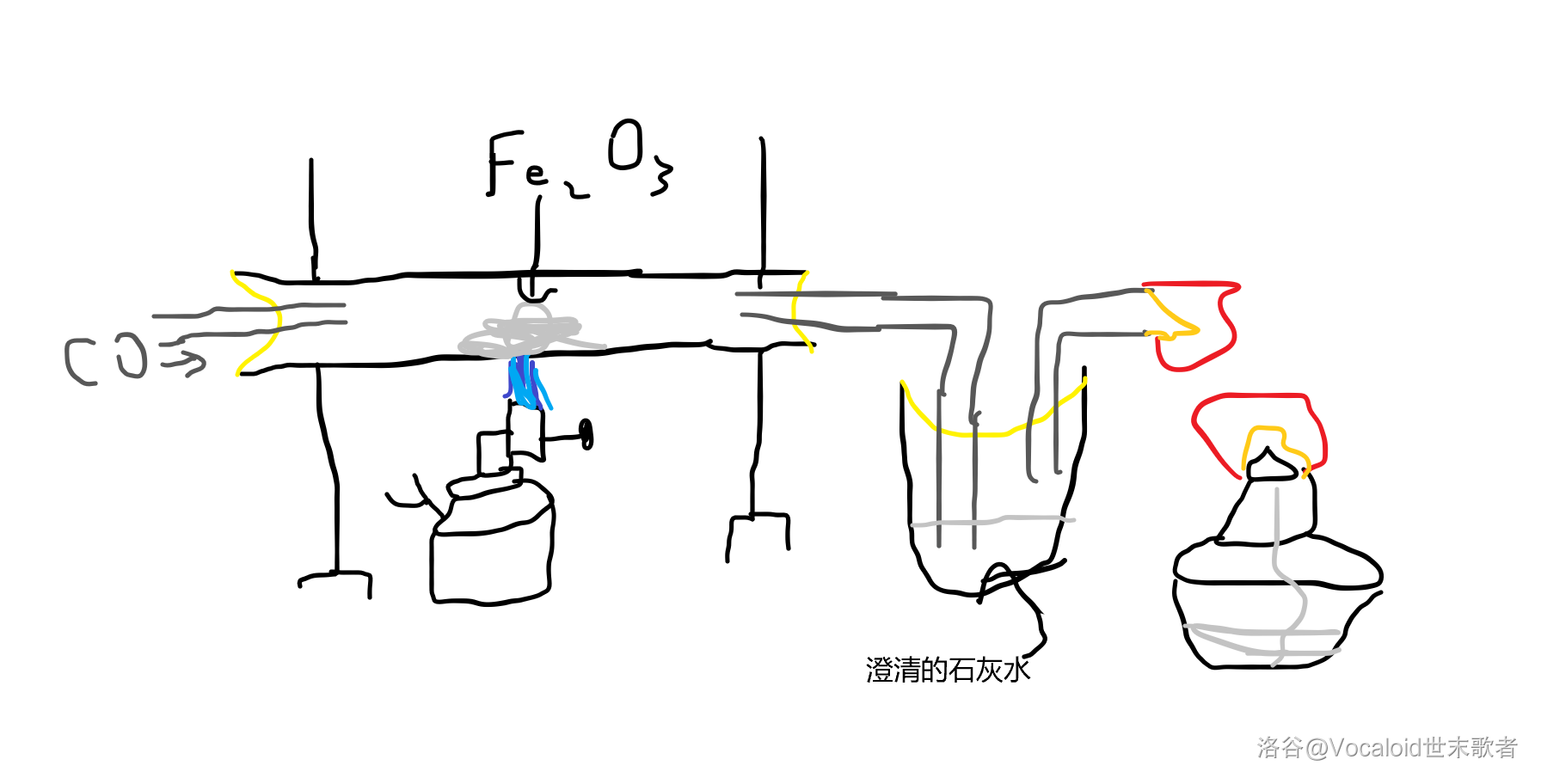
(我尽力了)
中间那个喷蓝色火的是酒精喷灯,原理是将酒精加热成气态,更充分燃烧,火焰温度比酒精灯外焰更高。
装置尾端的酒精灯是处理一氧化碳尾气的(你也不想让实验室里全是一氧化碳吧)。
关闭装置时先把喷灯关了,但要一直通 直到玻璃管冷却。可以防止倒吸石灰水,也可以避免空气干扰(防止刚冶炼出的生铁一下又变回去了)。
生铁含有少量的碳,是铁的一种合金(合金的硬度一般比组成它的单质高,熔点比组成它的单质低)硬度大但是脆,要进一步加工,成为钢。钢中再加入别的金属可以制成其他合金,比如不锈钢。
冶炼金属有三种主要的方法:加热(适用于非常不活泼的金属),高温加热(比较不活泼的金属),熔化后电解(活泼的金属,甚至有时还要加催化剂)。
铁锈
只有同时有氧气和水时才会出现,所以可以镀膜或者擦干水避免生锈。
记得在初中都当作是 。
铁锈呈红褐色,疏松多孔,不能阻挡内部进一步的氧化。但是更活泼的金属的氧化膜可以阻挡进一步的氧化
氧气
我都快写完了才想起来没写,
氧气微溶于水,无色无味,支持呼吸。
氧气具有助燃性,因此检验氧气时可以伸一个带火星的小木条,如果复燃了就是氧气。
物质在氧气中的燃烧比在空气中的燃烧更加剧烈,氧气还可以让一些在空气中不燃烧的物质燃烧,比如 。
水
为什么水和氧气我会放在最后?????
水的净化
不溶性杂质可以沉降(加明矾 )。
可以拿活性炭吸附一部分杂质。
还有过滤,实验室中过滤的方法很简单,要点是:叠滤纸并使滤纸一边一层一边三层,用三层那侧过滤;倒水的时候让水沿着玻璃棒留到滤纸上。
重点讲一下蒸馏,还有硬水软水。
蒸馏
又到了喜闻乐见的渣画时间!
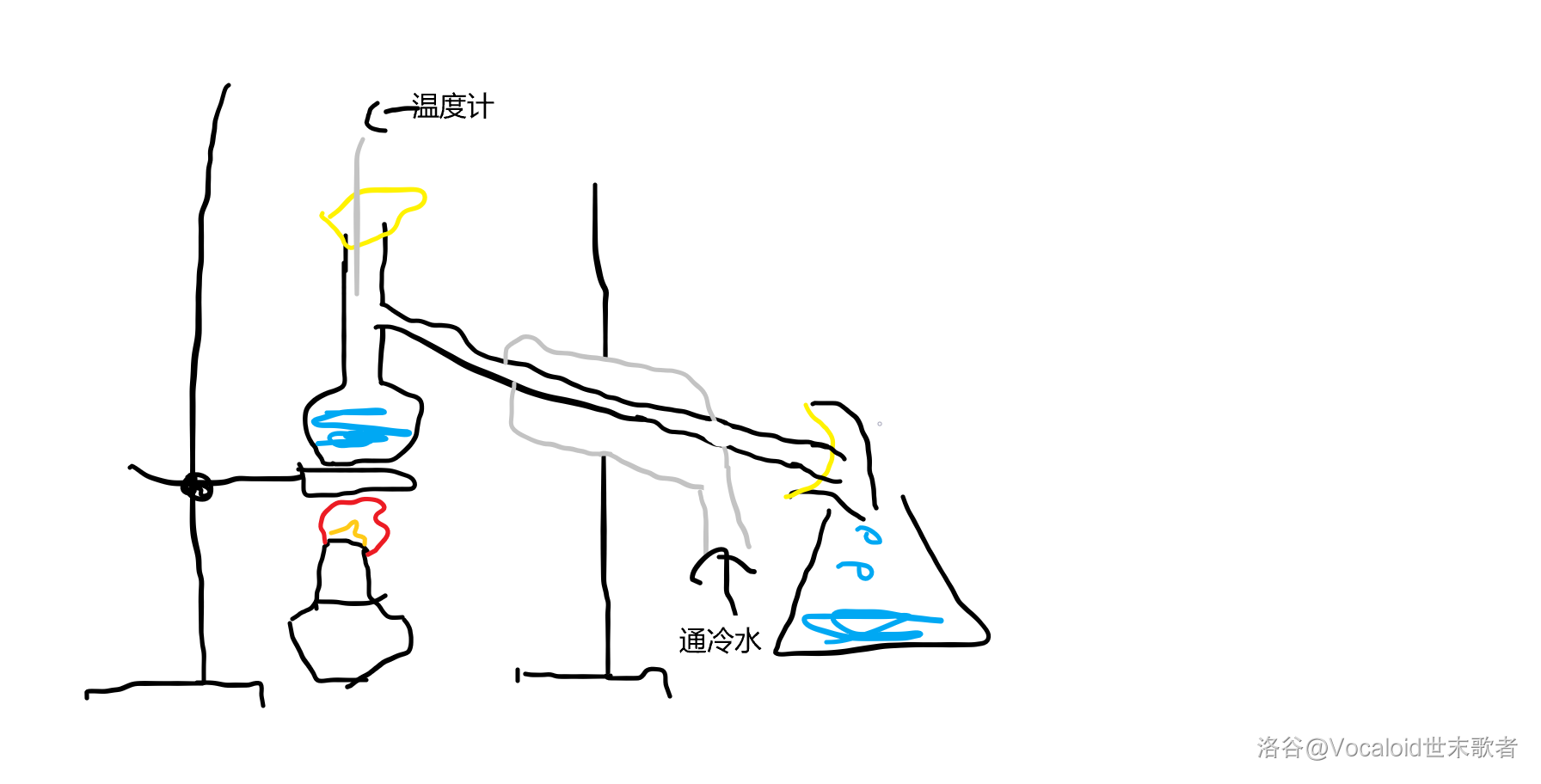
中部的冷凝管中通冷水,左边的烧瓶叫馏烧瓶,右边那个长得很抽象的管子叫“牛角管”,或者“尾接管”。
馏烧瓶中除了水还要加入一点碎瓷片或者沸石,防止暴沸(注意是“暴躁”的“暴”而不是“爆炸”的“爆”)。
温度计示数达到 时开始收集,得到的液体叫做馏分,最初的馏分先丢弃因为可能含有杂质。最终得到的水叫蒸馏水。
硬水、软水
自来水中含有比较多的可溶的钙、镁化合物,这种水称为硬水,相对的,含量较少的就叫软水。
硬水在加热时产生水垢,在工业上非常危险。另外,拿硬水洗衣服也不好(原因见下)。硬水也不好喝。
区分硬水和软水的方法,是往里加肥皂水并搅拌。软水中产生很多肥皂泡,硬水则会产生大量浮渣并产生非常少的肥皂泡(所以不能拿硬水洗衣服)。
将硬水转化为软水的方法就是加热煮沸,虽然会留下水垢但能净化,称为硬水的软化。
总结
我的初三化学是找网课几天速通的,不是很牢。本专栏内容部分来源于网课的讲义。
只能说,学习化学的最好方法是:秒了这套卷,祝你们满分(滑稽 多做题。
大家加油,祝中考化学满分!
Footnotes
-
这里本来有所谓“盐酸根”的,但是过于不严谨,已经删除。 ↩
-
读作臭氧。 ↩
-
原子团一定不能“合并同类项”!(有机物也不能因为有“——基”) ↩
-
由于 并不支持化学方程式的书写(也许是我不知道,欢迎告知),我将把中间的等号写作 (这个不代表没有配平,只是没法同时兼顾上下的反应条件和等号)或者 这种格式。请大家在考试中一定正常去写等号/上下写! ↩
-
电离:溶于水后形成带电离子。也称“解离”。 ↩
-
严格来说盐酸是氯化氢的水溶液,管它呢。 ↩
-
可溶“2”,微溶“1”,难溶“0”,不稳定“X” ↩
-
温度和压强相同时,气体密度与相对分子质量成正比;空气的平均相对分子质量取 。 ↩
-
有个小技巧,在初中阶段,绿的溶液含有二价铁(...亚铁),棕黄的含有三价铁,蓝的含有铜,紫色的是高锰酸钾溶液。 ↩
-
很特殊,含有一个二价铁和两个三价铁,一般考试不会出这么阴间的东西。 ↩
相关推荐
评论
共 33 条评论,欢迎与作者交流。
正在加载评论...